Triumeq 5 mg / 60 mg / 30 mg dispergoituva tabletti
dolutegraviiri/abakaviiri/lamivudiini
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain hoidettavalle lapselle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin hoidettavalla lapsella.
- Jos havaitset lapsella haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Triumeq on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät Triumeq‑valmistetta
3. Miten Triumeq‑valmistetta otetaan
4. Mahdolliset haittavaikutukset
5. Triumeq‑valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
7. Vaiheittaiset käyttöohjeet
1. Mitä valmiste on ja mihin sitä käytetään
Triumeq on lääke, joka sisältää kolmea HIV:n hoitoon käytettävää vaikuttavaa ainetta: abakaviiria, lamivudiinia ja dolutegraviiria. Abakaviiri ja lamivudiini ovat nukleosidianalogikäänteiskopioijaentsyymin estäjiksi (NRTI) kutsuttuja retroviruslääkkeitä ja dolutegraviiri kuuluu integraasin estäjiksi (INI) kutsuttuihin retroviruslääkkeisiin.
Triumeq‑valmistetta käytetään HIV:n (ihmisen immuunikatoviruksen) aiheuttaman infektion hoitoon lapsille, jotka painavat vähintään 14 kg mutta alle 25 kg.
Ennen kuin lääkäri määrää hoidettavalle lapselle Triumeq‑valmistetta, lapselle tehdään koe, jolla selvitetään, onko hän tietyn tyyppisen HLA‑B*5701:ksi kutsutun geenin kantaja. Triumeq‑valmistetta ei saa käyttää, jos potilaan tiedetään olevan HLA‑B*5701‑geenin kantaja. Potilailla, joilla on tämä geeni, on suuri vakavien yliherkkyysreaktioiden (allergisten reaktioiden) kehittymisen riski, jos he käyttävät Triumeq‑valmistetta (ks. kohta Mahdolliset haittavaikutukset Yliherkkyysreaktiot).
Triumeq ei paranna HIV‑infektiota. Se vähentää virusten määrää elimistössä ja pitää määrän pienenä. Tämän seurauksena myös CD4‑solujen määrä veressä suurenee. CD4‑solut ovat tietyntyyppisiä veren valkosoluja, joilla on tärkeä tehtävä elimistön taistelussa infektioita vastaan.
Triumeq‑hoito ei tehoa kaikkiin ihmisiin samalla tavalla. Lääkäri seuraa hoidon tehoa.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Triumeq‑valmistetta
- jos hoidettava lapsi on allerginen (yliherkkä) dolutegraviirille, abakaviirille (tai jollekin muulle abakaviiria sisältävälle lääkkeelle) tai lamivudiinille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Lue huolella yliherkkyysreaktioita koskeva tieto kohdasta Mahdolliset haittavaikutukset.
- jos hoidettava lapsi käyttää fampridiini‑nimistä lääkettä (tunnetaan myös nimellä dalfampridiini; käytetään multippeliskleroosin hoidossa).
→ Kerro lääkärille, jos epäilet, että jokin näistä koskee lasta.
Varoitukset ja varotoimet
TÄRKEÄÄ – Yliherkkyysreaktiot
Triumeq sisältää abakaviiria ja dolutegraviiria. Nämä molemmat vaikuttavat aineet voivat aiheuttaa vakavan allergisen reaktion, jota kutsutaan yliherkkyysreaktioksi. Jos hoidettava lapsi saa yliherkkyysreaktion, lapsen ei tulisi enää koskaan ottaa abakaviiria tai abakaviiria sisältäviä valmisteita: se voi olla hengenvaarallista.
Lue huolella kaikki otsikon "Yliherkkyysreaktiot" alla olevan laatikon tiedot kohdassa Mahdolliset haittavaikutukset.
Triumeq‑pakkaus sisältää varoituskortin, jolla muistutetaan sinua ja hoitohenkilökuntaa yliherkkyydestä. Irrota tämä kortti ja pidä se aina mukanasi.
Ole erityisen varovainen Triumeqin suhteen
Jotkut Triumeq‑valmistetta tai muita HIV‑yhdistelmähoitoja saavat ovat muita alttiimpia vakaville haittavaikutuksille. Ota huomioon, että riski voi olla suurempi:
- jos hoidettavalla lapsella on keskivaikea tai vaikea maksasairaus
- jos hoidettavalla lapsella on joskus ollut jokin maksasairaus, mukaan lukien hepatiitti B tai C (jos lapsella on hepatiitti B ‑infektio, Triumeq‑valmisteen käyttöä ei saa lopettaa ilman lääkärin kehotusta, koska hepatiitti voi uusiutua)
- jos hoidettavalla lapsella on munuaisvaivoja.
→ Keskustele lääkärin kanssa ennen Triumeq‑valmisteen käyttöä, jos jokin yllä mainituista koskee hoidettavaa lasta. Lapsen voi olla tarpeen käydä useammin tarkastuksissa, myös verikokeissa, lääkehoidon aikana. Ks. lisätietoja kohdasta Mahdolliset haittavaikutukset.
Abakaviiriyliherkkyysreaktiot
Myös potilaat, joilla ei ole HLA‑B*5701:ksi kutsuttua geeniä, voivat saada yliherkkyysreaktion (vakavan allergisen reaktion).
→ Lue huolella kaikki yliherkkyysreaktioita koskeva tieto tämän pakkausselosteen kohdasta Mahdolliset haittavaikutukset.
Sydän- ja verisuonitapahtumien riski
Ei voida sulkea pois mahdollisuutta, että abakaviiri saattaa suurentaa sydän- ja verisuonitapahtumien riskiä.
→ Kerro lääkärille, jos hoidettavalla lapsella on sydän- ja verisuonivaivoja, jos lapsi tupakoi tai jos lapsella on jokin sairaus, joka voi suurentaa sydän- ja verisuonisairauksien riskiä, kuten korkea verenpaine tai diabetes. Älä lopeta Triumeq‑hoidon antamista, ellei lääkäri kehota sinua tekemään niin.
Tarkkaile tärkeitä oireita
Joillekin HIV‑lääkkeitä käyttäville potilaille voi kehittyä myös muita tiloja, jotka voivat olla vakavia. Tällaisia voivat olla:
- infektioiden ja tulehduksen oireet
- nivelkipu, jäykkyys ja luusto‑oireet.
Sinun on tärkeää tietää, millaisiin merkkeihin ja oireisiin on kiinnitettävä huomiota, kun annat Triumeq‑valmistetta.
→ Lue kohta ”Muut mahdolliset HIV‑yhdistelmähoidon haittavaikutukset” tämän pakkausselosteen kohdasta Mahdolliset haittavaikutukset.
Lapset
Tätä lääkettä ei ole tarkoitettu alle 14 kg painaville lapsille, sillä lääkkeen jokaisen vaikuttavan aineen määrää ei voida muuttaa painon mukaan.
Lasten tulee käydä sovituilla lääkärikäynneillä (lisätiedot, ks. kohta Miten valmistetta käytetään ”Miten Triumeq‑valmistetta annetaan”).
Muut lääkevalmisteet ja Triumeq
Kerro lääkärille, jos hoidettava lapsi parhaillaan ottaa, on äskettäin ottanut tai saattaa ottaa muita lääkkeitä.
Jotkin lääkkeet voivat vaikuttaa Triumeq‑valmisteen tehoon tai lisätä haittavaikutusten todennäköisyyttä. Triumeq voi myös vaikuttaa joidenkin muiden lääkkeiden tehoon.
Kerro lääkärille, jos hoidettava lapsi käyttää jotakin seuraavassa luettelossa mainittua lääkettä:
- metformiini, jota käytetään diabeteksen hoitoon
- antasidit, joita käytetään ruuansulatusvaivojen ja närästyksen hoitoon. Älä anna antasidia 6 tunnin aikana ennen Triumeq‑annoksen ottamista tai vähintään 2 tuntiin Triumeq‑valmisteen ottamisen jälkeen (ks. myös kohta Miten valmistetta käytetään).
- ravintolisät tai monivitamiinivalmisteet, jotka sisältävät kalsiumia, rautaa tai magnesiumia. Jos annat Triumeqia ruuan kanssa, voit antaa ravintolisiä tai monivitamiinivalmisteita, jotka sisältävät kalsiumia, rautaa tai magnesiumia samaan aikaan Triumeqin kanssa. Jos et anna Triumeqia ruuan kanssa, älä anna ravintolisiä tai monivitamiinivalmisteita, jotka sisältävät kalsiumia, rautaa tai magnesiumia 6 tunnin aikana ennen Triumeq‑annoksen antamista tai vähintään 2 tuntiin Triumeq‑valmisteen antamisen jälkeen (ks. myös kohta Miten valmistetta käytetään).
- emtrisitabiini, etraviriini, efavirentsi, nevirapiini tai tipranaviiri‑ritonaviiriyhdistelmä, joita käytetään HIV‑infektion hoitoon
- säännöllisesti käytettävät sorbitolia ja muita sokerialkoholeja (esim. ksylitoli, mannitoli, laktitoli tai maltitoli) sisältävät lääkkeet (usein nesteitä)
- muut lamivudiinia sisältävät lääkkeet, joita käytetään HIV‑ tai hepatiitti B ‑infektion hoitoon
- kladribiini, jota käytetään karvasoluleukemian hoitoon
- rifampisiini, jota käytetään tuberkuloosin ja muiden bakteeri‑infektioiden hoitoon
- trimetopriimi‑sulfametoksatsoliyhdistelmää, joka on bakteeri‑infektioiden hoitoon käytetty antibiootti
- fenytoiini ja fenobarbitaali, joita käytetään epilepsian hoitoon
- okskarbatsepiini ja karbamatsepiini, joita käytetään epilepsian tai kaksisuuntaisen mielialahäiriön hoitoon
- mäkikuisma (Hypericum perforatum), joka on masennuksen hoitoon käytettävä rohdosvalmiste
- metadoni, jota käytetään heroiinin korvaushoitona. Abakaviiri nopeuttaa metadonin poistumista elimistöstä. Jos hoidettava lapsi käyttää metadonia, lapsen tilaa seurataan vieroitusoireiden havaitsemiseksi. Metadoniannosta voidaan joutua muuttamaan.
→ Kerro lääkärille tai apteekkihenkilökunnalle, jos hoidettava lapsi käyttää jotakin näistä. Lääkäri saattaa muuttaa lapsen annosta tai määrätä ylimääräisiä seurantakäyntejä.
Raskaus
Potilaat, jotka ovat raskaana, epäilevät olevansa raskaana tai suunnittelevat lapsen hankkimista:
→ Keskustele lääkärin kanssa Triumeq‑hoidon riskeistä ja hyödyistä.
Triumeq‑valmisteen ottaminen raskaaksi tulemisen aikaan tai raskauden 6 ensimmäisen viikon aikana voi suurentaa hermostoputken kehityshäiriön, kuten spina bifidan (selkärankahalkion), kaltaisen synnynnäisen vian riskiä.
Potilaat, jotka voivat tulla raskaaksi käyttäessään Triumeq‑valmistetta:
→ Keskustele lääkärin kanssa siitä, onko sinun aiheellista käyttää ehkäisyä, esimerkiksi kondomeja tai ehkäisytabletteja.
Kerro lääkärillesi heti, jos tulet raskaaksi tai suunnittelet raskautta. Lääkäri tarkistaa lääkityksesi. Älä lopeta Triumeq‑valmisteen käyttöä keskustelematta siitä lääkärisi kanssa, sillä siitä voi olla haittaa sinulle ja syntymättömälle lapsellesi.
Imetys
Imettämistä ei suositella HIV‑positiivisille naisille, koska HIV‑infektio saattaa tarttua lapseen äidinmaidon välityksellä.
Pieni määrä Triumeq‑valmisteen sisältämiä aineita voi myös erittyä rintamaitoon.
Jos imetät tai harkitset imettämistä, keskustele asiasta lääkärin kanssa mahdollisimman pian .
Ajaminen ja koneiden käyttö
Triumeq voi aiheuttaa huimausta ja muita haittavaikutuksia, jotka heikentävät havaintokykyäsi.
→ Älä aja tai käytä koneita, ellet ole varma, ettei havaintokykysi ole heikentynyt.
Triumeq sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per dispergoituva tabletti eli sen voidaan sanoa olevan ”natriumiton”.
3. Miten valmistetta käytetään
Anna tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
Lääkäri määrittää sopivan Triumeq‑annoksen hoidettavalle lapselle lapsen painon perusteella.
Jos hoidettava lapsi painaa alle 14 kg, Triumeq ei sovellu lapselle, sillä ei tiedetä, onko Triumeq tällöin turvallinen ja tehokas. Lääkäri määrää lapselle vaikuttavia aineita erikseen.
Triumeq voidaan antaa aterian yhteydessä tai tyhjään mahaan.
Dispergoituvat tabletit on hajotettava juomaveteen. Tablettien on hajottava veteen täysin ennen nielemistä. Tabletteja ei saa pureskella, pilkkoa tai murskata.
Lasten Triumeq‑annosta on muutettava lapsen painon noustessa.
→ Onkin tärkeää, että lapset käyvät sovituilla lääkärikäynneillä.
Triumeq on saatavilla kalvopäällysteisinä ja dispergoituvina tabletteina. Kalvopäällysteiset ja dispergoituvat tabletit eivät ole samanlaisia. Tästä syystä et saa vaihtaa kalvopäällysteisiä ja dispergoituvia tabletteja toisiinsa keskustelematta ensin lääkärin kanssa.
Älä anna antasidia 6 tunnin aikana ennen Triumeq‑annoksen antamista tai vähintään 2 tuntiin Triumeq‑valmisteen antamisen jälkeen. Muut mahalaukun happamuutta vähentävät lääkkeet, kuten ranitidiini ja omepratsoli, voidaan ottaa samaan aikaan Triumeq‑valmisteen kanssa.
→ Pyydä lääkäriltä lisäohjeita antasidien käytöstä Triumeq‑valmisteen kanssa.
Jos annat Triumeqia ruuan kanssa, voit antaa ravintolisiä tai monivitamiinivalmisteita, jotka sisältävät kalsiumia, rautaa tai magnesiumia, samaan aikaan Triumeqin kanssa. Jos et anna Triumeqia ruuan kanssa, älä anna kalsiumia, rautaa tai magnesiumia sisältävää ravintolisää tai monivitamiinivalmistetta 6 tunnin aikana ennen Triumeq‑annoksen antamista tai vähintään 2 tuntiin Triumeq‑valmisteen antamisen jälkeen.
→ Pyydä lääkäriltä lisäohjeita kalsiumia‑, rautaa‑ tai magnesiumia sisältävien ravintolisien tai monivitamiinivalmisteiden käytöstä Triumeq‑valmisteen kanssa.
Jos annat enemmän Triumeq‑valmistetta kuin sinun pitäisi
Jos annat liian monta dispergoituvaa Triumeq‑tablettia, kysy neuvoa lääkäriltä tai apteekista. Näytä heille Triumeq‑pakkaus, jos mahdollista.
Jos unohdat antaa Triumeq‑valmistetta
Jos unohdat antaa annoksen, anna se heti muistaessasi. Jos kuitenkin seuraava annos pitäisi antaa jo alle 4 tunnin kuluttua, jätä unohtunut annos väliin ja anna seuraava annos normaaliin aikaan. Jatka sen jälkeen lapsen hoitoa kuten aikaisemmin.
→ Älä anna kaksinkertaista annosta korvataksesi unohtamasi kerta‑annoksen.
Jos olet lopettanut Triumeq‑valmisteen antamisen
Jos olet lopettanut Triumeq‑valmisteen antamisen lapselle mistä tahansa syystä – varsinkin jos olet lopettanut lääkevalmisteen antamisen siitä syystä, että epäilet lapsen saaneen haittavaikutuksia, tai siksi, että lapsella on muu sairaus:
Keskustele lääkärin kanssa ennen kuin alat antaa lääkettä uudestaan. Lääkäri tarkistaa, liittyivätkö lapsen oireet yliherkkyysreaktioon. Jos lääkäri on sitä mieltä, että oireet voivat liittyä yliherkkyysreaktioon, sinua kielletään enää koskaan antamasta lapselle Triumeq‑valmistetta tai muuta abakaviiria tai dolutegraviiria sisältävää lääkettä. On tärkeää, että noudatat tätä ohjetta.
Jos lääkäri kertoo, että voit aloittaa Triumeq‑hoidon antamisen uudelleen, sinua saatetaan pyytää antamaan ensimmäiset annokset paikassa, jossa lapselle on tarvittaessa saatavilla lääketieteellistä apua.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Kun hoidetaan HIV‑infektiota, voi olla vaikea sanoa, johtuvatko oireet Triumeq‑valmisteesta, muista samanaikaisesti otetuista lääkkeistä vai itse HIV‑taudista. Tästä syystä on erittäin tärkeää, että kerrot lääkärille kaikista lapsen terveydessä tapahtuvista muutoksista.
Abakaviiri voi aiheuttaa yliherkkyysreaktion (vakavan allergisen reaktion), erityisesti sellaisilla henkilöillä, jotka ovat HLA‑B*5701‑geenin kantajia. Myös potilaat, joilla ei ole HLA‑B*5701:ksi kutsuttua geeniä, voivat saada yliherkkyysreaktion, jota kuvataan tässä pakkausselosteessa laatikossa, jonka otsikkona on ”Yliherkkyysreaktiot”. On hyvin tärkeää, että luet ja ymmärrät tätä vakavaa reaktiota koskevan tiedon.
Alla lueteltujen Triumeq‑valmisteen haittavaikutusten lisäksi HIV‑yhdistelmähoidon aikana voi kehittyä muitakin tiloja.
On tärkeää lukea tässä osiossa otsikolla ”Muut mahdolliset HIV‑yhdistelmähoidon haittavaikutukset” kerrottu tieto.
Yliherkkyysreaktiot
Triumeq sisältää abakaviiria ja dolutegraviiria. Nämä molemmat vaikuttavat aineet voivat aiheuttaa vakavan allergisen reaktion, joka tunnetaan yliherkkyysreaktiona.
Näitä yliherkkyysreaktioita on havaittu enemmän abakaviiria sisältäviä lääkkeitä käyttävillä henkilöillä.
Kuka saa näitä reaktioita?
Kuka tahansa Triumeq‑valmistetta saava potilas voi saada yliherkkyysreaktion, joka voi olla hengenvaarallinen, jos Triumeq‑hoitoa jatketaan.
Henkilöillä, joilla on HLA‑B*5701:ksi kutsuttu geeni, on suurempi todennäköisyys saada yliherkkyysreaktio (mutta lapsi voi saada reaktion, vaikka hänellä ei olisi tätä geeniä). Geenitesti, jolla tämä geeni poissuljetaan, tulee tehdä jo ennen kuin hoidettavalle lapselle määrätään Triumeq‑valmistetta. Jos tiedät, että lapsella on tämä geeni, kerro siitä lääkärille.
Millaisia oireet ovat?
Yleisimpiä oireita ovat:
kuume ja ihottuma.
Muita yleisiä oireita ovat:
pahoinvointi, oksentelu, ripuli, vatsakipu, voimakas väsymys.
Muita oireita ovat:
nivel‑ tai lihaskivut, niskan turpoaminen, hengästyminen, kurkkukipu, yskä, satunnaiset päänsäryt,
silmätulehdukset (konjunktiviitti), haavaumat suussa, matala verenpaine, käsien tai jalkojen kihelmöinti tai puutuminen.
Milloin näitä reaktioita ilmenee?
Yliherkkyysreaktiot voivat alkaa koska tahansa Triumeq‑hoidon aikana, mutta ne ovat todennäköisempiä kuuden ensimmäisen hoitoviikon aikana.
Ota heti yhteys lääkäriin:
1 jos lapsi saa ihottumaa TAI
2 jos lapsi saa oireita vähintään kahdesta seuraavasta oireryhmästä:
- kuume
- hengästyminen, kurkkukipu tai yskä
- pahoinvointi tai oksentelu, ripuli tai vatsakipu
- voimakas väsymys tai säryt ja kivut tai yleinen huonovointisuuden tunne.
Lääkäri saattaa kehottaa sinua lopettamaan Triumeq‑valmisteen antamisen.
Jos olet lopettanut Triumeq‑valmisteen antamisen
Jos olet lopettanut Triumeq‑valmisteen antamisen lapselle yliherkkyysreaktion vuoksi, et saa KOSKAAN ENÄÄ antaa lapselle Triumeq‑valmistetta tai mitään muuta abakaviiria sisältäviä lääkkeitä. Jos annat niitä, lapsen verenpaine voi laskea vaarallisen alas jo tuntien sisällä ja tämä voi johtaa kuolemaan. Älä myöskään enää koskaan anna lapselle dolutegraviiria sisältäviä lääkkeitä.
Jos lapsi on lopettanut Triumeq‑valmisteen oton mistä tahansa syystä – varsinkin siitä syystä, että epäilet lapsen saaneen haittavaikutuksia, tai siksi, että lapsella on muu sairaus:
Keskustele lääkärin kanssa ennen kuin aloitat hoidon uudestaan. Lääkäri tarkistaa, liittyivätkö lapsen oireet yliherkkyysreaktioon. Jos lääkäri on sitä mieltä, että ne ovat voineet olla yliherkkyysreaktion oireita, sinua kielletään enää koskaan antamasta lapselle Triumeq‑valmistetta tai muuta abakaviiria sisältävää lääkettä. Sinua voidaan myös kieltää enää koskaan antamasta lapselle dolutegraviiria sisältäviä lääkkeitä. On tärkeää, että noudatat tätä ohjetta.
Joskus henkilöt, joilla on ollut vain yksi varoituskortissa mainituista oireista ennen hoidon lopettamista ja jotka ovat aloittaneet abakaviirihoidon uudelleen, ovat saaneet yliherkkyysreaktion.
Erittäin harvoin henkilöt, jotka ovat ottaneet abakaviiria sisältäviä lääkkeitä aiemmin ilman yliherkkyyden oireita, ovat saaneet yliherkkyysreaktion, kun he aloittavat näiden lääkkeiden ottamisen uudestaan.
Jos lääkäri kertoo, että voit aloittaa Triumeq‑hoidon antamisen uudelleen, sinua saatetaan pyytää antamaan ensimmäiset annokset paikassa, jossa lapselle on tarvittaessa saatavilla lääketieteellistä apua.
Jos lapsi on yliherkkä Triumeq‑valmisteelle, toimita kaikki käyttämättömät Triumeq‑tabletit hävitettäväksi turvallisesti. Kysy neuvoa lääkäriltä tai apteekista.
Triumeq‑pakkaus sisältää varoituskortin, jolla muistutetaan sinua ja hoitohenkilökuntaa yliherkkyysreaktioista. Irrota tämä kortti ja pidä se aina mukanasi.
Hyvin yleiset haittavaikutukset
Näitä saattaa ilmetä yli yhdellä henkilöllä kymmenestä:
- päänsärky
- ripuli
- pahoinvointi
- nukkumisvaikeudet (unettomuus)
- energian puute (uupumus).
Yleiset haittavaikutukset
Näitä saattaa ilmetä enintään 1 henkilöllä kymmenestä:
- yliherkkyysreaktio (ks. kohta Yliherkkyysreaktiot edellä)
- ruokahaluttomuus
- ihottuma
- kutina
- oksentelu
- maha‑ (vatsa‑) kipu
- maha‑ (vatsa‑) vaivat
- painonnousu
- ruuansulatusvaivat
- ilmavaivat
- heitehuimaus
- poikkeavat unet
- painajaiset
- masennus (syvän surun tai arvottomuuden tunne)
- ahdistuneisuus
- väsymys
- uneliaisuus
- kuume
- yskä
- ärtynyt tai vuotava nenä
- hiusten lähtö
- lihaskipu ja ‑vaivat
- nivelkipu
- heikotuksen tunne
- yleinen huonon olon tunne.
Yleisiä verikokeissa havaittavia haittavaikutuksia:
- maksaentsyymiarvojen nousu.
Melko harvinaiset haittavaikutukset
Näitä saattaa ilmetä enintään 1 henkilöllä sadasta:
- maksatulehdus (hepatiitti)
- itsemurha‑ajatukset tai ‑käyttäytyminen (erityisesti potilailla, joilla on aikaisemmin ollut masennusta tai mielenterveysongelmia)
- paniikkikohtaus.
Melko harvinaisia verikokeissa havaittavia haittavaikutuksia:
- veren hyytymisen kannalta tärkeiden verisolujen määrän lasku (trombosytopenia)
- alhainen veren punasolujen määrä (anemia) tai pieni valkosolujen määrä (neutropenia)
- veren sokeriarvojen (glukoosiarvojen) kohoaminen
- veren triglyseridiarvojen (rasva‑arvojen) kohoaminen.
Harvinaiset haittavaikutukset
Näitä saattaa ilmetä enintään 1 henkilöllä tuhannesta:
- haimatulehdus (pankreatiitti)
- lihaskudoksen hajoaminen
- maksan vajaatoiminta (oireena voi olla ihon ja silmänvalkuaisten kellastuminen tai epätavallisen tumma virtsa)
- itsemurha (erityisesti potilailla, joilla on aikaisemmin ollut masennusta tai mielenterveysongelmia)
→ Kerro välittömästi lääkärille, mikäli hoidettava lapsi kokee mitä tahansa mielenterveysongelmia (ks. myös muut mielenterveysongelmat yllä).
Harvinaisia verikokeissa havaittavia haittavaikutuksia ovat:
- bilirubiinimäärän kasvu (maksan toiminnasta kertova koe)
- amylaasiksi kutsutun entsyymin määrän lisääntyminen.
Hyvin harvinaiset haittavaikutukset
Näitä saattaa ilmetä enintään 1 henkilöllä kymmenestätuhannesta:
- tunnottomuus, kihelmöinti iholla (pistely)
- heikkouden tunne raajoissa
- ihottuma, jossa voi muodostua rakkuloita ja joka näyttää pieniltä maalitauluilta (keskellä tumma läikkä, jonka ympärillä vaaleampi alue ja reunoilla tumma rengas) (monimuotoinen punavihoittuma, erythema multiforme)
- laajalle levinnyt ihottuma, jossa on rakkuloita ja jossa iho kuoriutuu, erityisesti suun, nenän, silmien ja sukupuolielinten alueelta (Stevens–Johnsonin oireyhtymä) ja vielä vakavampi ihottumamuoto, jossa ihoa kuoriutuu yli 30 %:ssa kehon pinta‑alasta (toksinen epidermaalinen nekrolyysi)
- maitohappoasidoosi (liikaa maitohappoa veressä).
Hyvin harvinaisia verikokeissa havaittavia haittavaikutuksia ovat:
- luuytimen kyvyttömyys tuottaa uusia veren punasoluja (puhdas punasoluaplasia).
Jos havaitset hoidettavalla lapsella haittavaikutuksia,
→ Keskustele lääkärin kanssa. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa.
Muut mahdolliset HIV‑yhdistelmähoidon haittavaikutukset
Yhdistelmähoito, kuten Triumeq, voi aiheuttaa muita oireita HIV‑hoidon aikana.
Infektion ja tulehduksen oireet
Henkilöillä, joilla on pitkälle edennyt HIV‑infektio tai AIDS, on heikko immuunijärjestelmä ja heidän todennäköisyytensä saada vakavia infektioita (opportunistisia infektioita) on muita suurempi.
Tällaiset infektiot ovat voineet olla ”hiljaisina” ja heikko immuunijärjestelmä ei ole havainnut niitä ennen hoidon aloittamista. Hoidon aloittamisen jälkeen immuunijärjestelmä vahvistuu ja saattaa hyökätä näiden infektioiden kimppuun, mikä voi aiheuttaa infektion tai tulehduksen oireita. Oireita ovat yleensä kuume ja joitakin seuraavista:
- päänsärky
- vatsakipu
- hengitysvaikeudet.
Harvinaisissa tapauksissa immuunijärjestelmä voi vahvistuessaan hyökätä myös terveitä kudoksia vastaan (autoimmuunisairaudet). Autoimmuunisairauksien oireet voivat ilmetä useita kuukausia HIV‑infektion hoidon aloittamisen jälkeen. Oireita voivat olla:
- sydämentykytys (nopea tai epäsäännöllinen syke) tai vapina
- yliaktiivisuus (liiallinen levottomuus tai liikehdintä)
- käsistä tai jaloista alkavaa heikkoutta, joka etenee kohti vartaloa.
Jos lapsi saa infektion tai tulehduksen oireita tai jonkin yllä mainituista oireista:
→ Kerro heti lääkärille. Älä anna muita lääkkeitä infektion hoitoon ilman lääkärin ohjeita.
Nivelkipu, jäykkyys ja luustovaivat
Joillekin HIV‑yhdistelmähoitoa saaville potilaille voi kehittyä luukuolio eli osteonekroosi. Tässä sairaudessa osa luukudoksesta kuolee, koska luun verenkiertoon heikentynyt. Tämän sairauden riski voi olla suurentunut:
- jos yhdistelmähoito on jatkunut pitkään
- jos käytetään samanaikaisesti tulehduslääkkeinä kortikosteroideja
- jos potilas käyttää alkoholia
- jos immuunijärjestelmä on hyvin heikko
- jos potilas on ylipainoinen.
Osteonekroosin oireita ovat:
- nivelten jäykkyys
- säryt ja kivut (erityisesti lonkassa, polvessa tai hartiassa)
- liikkumisvaikeudet.
Jos lapsella on jonkin näistä oireista:
→ Kerro asiasta lääkärille.
Vaikutukset painoon, veren rasva‑arvoihin ja verensokeriarvoihin
HIV‑hoidon aikana saattaa esiintyä painonnousua ja veren rasva‑arvojen sekä verensokeriarvojen suurenemista. Tämä liittyy osittain terveydentilan ja elämäntapojen palautumiseen ennalleen, ja joskus myös itse HIV‑lääkkeisiin. Lääkäri määrää kokeita näiden muutosten havaitsemiseksi.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä kotelossa ja purkin etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle. Pidä purkki tiiviisti suljettuna. Älä poista kuivausainetta. Älä niele kuivausainetta.
Tämä lääke ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä Triumeq sisältää
- Vaikuttavat aineet ovat dolutegraviiri, abakaviiri ja lamivudiini. Yksi tabletti sisältää dolutegraviirinatriumia vastaten 5 mg dolutegraviiria, abakaviirisulfaattia vastaten 60 mg abakaviiria ja 30 mg lamivudiinia.
- Muut aineet ovat asesulfaamikalium, krospovidoni, mannitoli (E421), mikrokiteinen selluloosa, povidoni, silikonoitu mikrokiteinen selluloosa (mikrokiteinen selluloosa, kolloidinen vedetön piidioksidi), natriumtärkkelysglykolaatti, natriumstearyylifumaraatti, mansikkakerma‑aromi, sukraloosi, polyvinyylialkoholi (osittain hydrolysoitu), makrogoli, talkki, titaanidioksidi (E171) ja keltainen rautaoksidi (E172).
- Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per dispergoituva tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Lääkevalmisteen kuvaus ja pakkauskoot
Triumeq dispergoituvat tabletit ovat keltaisia, kaksoiskuperia, kapselinmuotoisia tabletteja, joiden toiselle puolelle on kaiverrettu ”SV WTU”.
Dispergoituvat tabletit ovat 90 tablettia sisältävissä purkeissa.
Purkki sisältää kuivausainetta kosteuden vähentämiseksi. Pidä kuivausaine purkissa avaamisen jälkeen, älä poista sitä.
Pakkaukseen sisältyy lääkemitta.
Myyntiluvan haltija
ViiV Healthcare BV, Van Asch van Wijckstraat 55H, 3811 LP Amersfoort, Alankomaat
Valmistaja
Glaxo Wellcome, S.A., Avda. Extremadura 3, 09400 Aranda De Duero, Burgos, Espanja
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi/Finland
GlaxoSmithKline Oy
Puh/Tel: + 358 (0)10 30 30 30
Tämä pakkausseloste on tarkistettu viimeksi 15.11.2023
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu .
Ohjeet käyttäjälle
7. Vaiheittaiset käyttöohjeet
|
Lue nämä käyttöohjeet ennen kuin annat lääkeannoksen.
Toteuta kaikki vaiheet ja käytä lapsen lääkeannoksen valmisteluun puhdasta juomavettä.
Tärkeää tietoa
Anna tätä lääkettä juuri siten kuin terveydenhuollon ammattilainen on neuvonut. Keskustele terveydenhuollon ammattilaisen kanssa, jos olet epävarma.
Tabletteja ei saa pureskella, pilkkoa eikä murskata.
Jos unohdat antaa lääkeannoksen, anna se heti kun muistat. Jos seuraavaan annokseen on kuitenkin alle 4 tuntia, jätä unohtunut annos väliin ja anna seuraava annos tavanomaiseen aikaan. Jatka sitten hoitoa kuten aiemminkin. Älä anna kahta annosta yhtä aikaa äläkä ylitä terveydenhuollon ammattilaisen määräämää annosta.
Jos lapsi ei ota tai ei pysty ottamaan koko annosta, ota yhteys terveydenhuollon ammattilaiseen.
Jos annat liikaa lääkettä, hanki välittömästi kiireellistä lääketieteellistä hoitoa.
|
|
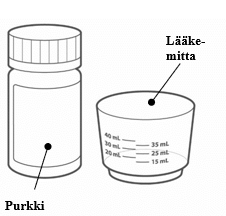
Pakkauksessa on seuraavat tarvikkeet:
- purkki, jossa on 90 tablettia
- lääkemitta
Muuta tarvittavaa:
|
|
Valmistautuminen
|
|
1. Kaada vesi

- Kaada lääkemittaan puhdasta juomavettä.
Edellä olevassa vesimääräohjeessa ilmoitetaan reseptin mukaiseen annokseen tarvittava vesimäärä.
Käytä vain juomavettä.
- Älä käytä annoksen valmisteluun mitään muuta juomaa äläkä ruokaa.
|
|
2. Valmistele lääke
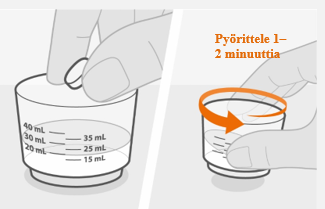
- Lisää veden sekaan reseptin mukainen määrä tabletteja.
- Pyörittele lääkemittaa varovasti 1–2 minuutin ajan tabletin/tablettien hajottamiseksi. Lääke muuttuu sameaksi. Varo, ettei lääkettä roisku.
- Tarkista, että lääke on valmista. Jos siinä on tablettipaakkuja, pyörittele lääkemittaa, kunnes ne hajoavat.
Jos lääkettä roiskuu, siivoa roiskeet.
Hävitä loput valmistelemastasi lääkkeestä ja valmista uusi annos.
|
|
Lääkeannos on annettava 30 minuutin kuluessa sen valmistamisesta. Jos valmistamisesta on kulunut yli 30 minuuttia, huuhdo koko annos vedellä pois lääkemitasta ja valmistele uusi lääkeannos.
|
|
Lääkkeen antaminen
|
|
3. Anna lääke
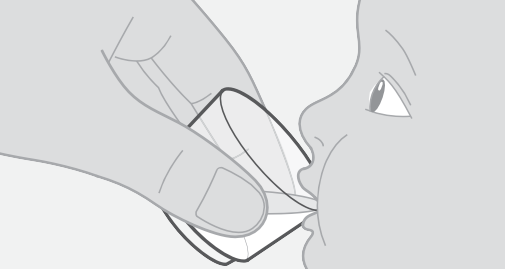
- Varmista, että lapsi on pystyasennossa. Anna lapselle koko valmistamasi lääkemäärä.
- Lisää lääkemittaan vielä enintään 15 ml juomavettä, pyörittele lääkemittaa ja anna kaikki neste lapselle.
- Toista tätä vaihetta, jos lääkemittaan jää lääkettä, jotta lapsi saa varmasti koko annoksen.
|
|
Puhdistus
|
|
4. Puhdista antovälineet
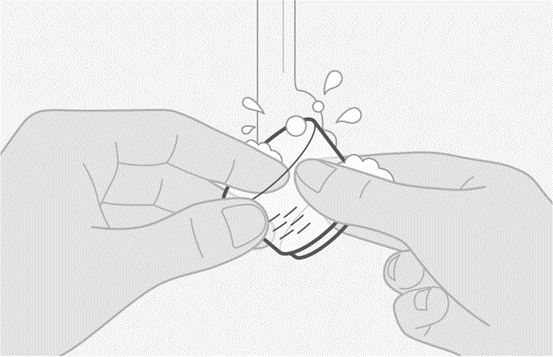
- Pese lääkemitta vedellä.
- Lääkemitta on puhdistettava ennen seuraavan annoksen valmistelua.
|
|
Säilytystiedot
|
|
Säilytä tabletit purkissa. Pidä purkki tiiviisti suljettuna.
Purkissa oleva kuivausainekapseli auttaa pitämään tabletit kuivina. Älä syö kuivausainetta. Älä poista kuivausainetta.
Pidä kaikki lääkkeet poissa lasten ulottuvilta.
|
|
Hävittämisohjeet
|
|
Kun purkin kaikki tabletit on otettu tai niitä ei enää tarvita, hävitä purkki ja lääkemitta paikallisten ohjeiden mukaisesti.
Seuraavassa pakkauksessa on uusi lääkemitta.
|