VEYVONDI 650 IU injektiokuiva‑aine ja liuotin, liuosta varten
VEYVONDI 1 300 IU injektiokuiva‑aine ja liuotin, liuosta varten
vonikogi alfa
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä VEYVONDI on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät VEYVONDI‑valmistetta
3. Miten VEYVONDI‑valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. VEYVONDI‑valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
1. Mitä valmiste on ja mihin sitä käytetään
VEYVONDI‑valmisteen vaikuttava aine, vonikogi alfa, on rekombinantti ihmisen von Willebrand ‑tekijä (rVWF). Se vaikuttaa samalla tavalla kuin ihmisen elimistössä luonnollisesti esiintyvä von Willebrand ‑tekijä (VWF). VWF on hyytymistekijä VIII:n kantajamolekyyli ja osallistuu veren hyytymiseen siten, että se saa verihiutaleet tarttumaan haavaan ja muodostamaan verihyytymän. VWF:n puutos suurentaa verenvuototaipumusta.
VEYVONDI‑valmistetta käytetään von Willebrandin tautia sairastavien aikuispotilaiden (vähintään 18‑vuotiaiden) verenvuotojen ehkäisyyn ja hoitoon, leikkauksiin liittyvät verenvuodot mukaan lukien. Sitä käytetään kun toinen, desmopressiiniksi kutsuttu lääke ei ole tehonnut tai sitä ei voida antaa.
Von Willebrandin tauti on perinnöllinen verenvuototauti, joka johtuu von Willebrand ‑tekijän täydellisestä tai osittaisesta puutoksesta. Tätä tautia sairastavien potilaiden veri ei hyydy normaalisti ja vuotoaika pitenee. Von Willebrand ‑tekijän (VWF) antaminen korjaa von Willebrand ‑tekijän puutoksen.
2. Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä VEYVONDI‑valmistetta
- jos olet allerginen vonikogi alfalle tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos olet allerginen hiiren tai hamsterin proteiineille
Jos et ole varma asiasta, kysy lääkäriltäsi.
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät VEYVONDI‑valmistetta.
On olemassa riski, että saat yliherkkyysreaktion (vaikea, äkillinen allerginen reaktio) VEYVONDI‑valmisteesta. Lääkärisi kertoo sinulle vaikeiden allergisten reaktioiden varhaisista merkeistä, joita ovat muun muassa syketiheyden nousu, ihottuma, nokkosihottuma, paukamat, yleistynyt kutina, huulten ja kielen turvotus, hengitysvaikeudet, hengityksen vinkuminen, puristava tunne rinnassa, nopea syke, nenän tukkoisuus, silmien punoitus, yleinen huonovointisuus ja huimaus. Nämä saattavat olla yliherkkyysreaktion varhaisvaiheen oireita. Jos saat mitään näistä oireista, keskeytä infuusio heti ja ota yhteyttä lääkäriin. Vaikeat oireet, kuten hengitysvaikeudet ja huimaus, vaativat nopeaa ensihoitoa.
Potilaat, joille kehittyy inhibiittoreita
Joillekin VWF‑lääkitystä saaville potilaille saattaa muodostua VWF‑inhibiittoreita (vasta‑aineita). Etenkin suurina pitoisuuksina esiintyessään nämä inhibiittorit saattavat estää hoitoa vaikuttamasta oikein. Sinua seurataan huolellisesti tällaisten inhibiittorien kehittymisen varalta.
- Kerro lääkärille heti, jos verenvuotoasi ei saada hallintaan VEYVONDI‑valmisteella.
Jos plasmasi VWF‑pitoisuus tai tekijä VIII ‑pitoisuus ei nouse odotetulle tasolle VEYVONDI‑hoidolla lääkärin seuraamien tutkimustulosten perusteella tai jos verenvuotoa ei saada riittävästi hallintaan, se voi johtua VWF‑ tai tekijä VIII ‑vasta‑aineiden muodostumisesta. Lääkärisi tarkistaa asian. Saatat tarvita suuremman VEYVONDI‑annoksen tai suuremman tekijä VIII ‑annoksen tai jopa jotakin toista lääkettä verenvuotojen hallitsemiseen. Älä suurenna VEYVONDI‑valmisteen kokonaisannosta verenvuodon hallitsemiseksi keskustelematta lääkärin kanssa.
Jos olet aikaisemmin saanut hoitoa plasmaperäisillä VWF‑konsentraateilla, sinulle on saattanut muodostua vasta‑aineita ja vasteesi VEYVONDI‑hoidolle voi olla heikentynyt niiden takia. Lääkärisi täytyy ehkä säätää annosta laboratoriotulosten perusteella.
Veritulpat
Jos sinulla on tiedossa olevia kliinisiä tai laboratorioarvoihin perustuvia riskitekijöitä, sinulla voi esiintyä verisuonitukostapahtumia. Siksi lääkäri seuraa sinua veritulpan varhaisvaiheen merkkien varalta.
Hyytymistekijä VIII ‑valmisteet voivat sisältää vaihtelevasti VWF:ää. Siksi VEYVONDI‑valmisteen kanssa samanaikaisesti annettavan FVIII‑valmisteen on oltava puhdas FVIII‑valmiste.
Jos sinulla on ollut aiemmin veritulppia tai verisuonitukoksia (tromboembolisia komplikaatioita), kerro asiasta välittömästi lääkärillesi.
Lapset ja nuoret
VEYVONDI‑valmistetta ei ole hyväksytty alle 18 vuoden ikäisten lasten ja nuorten hoitoon.
Muut lääkevalmisteet ja VEYVONDI
Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä, apteekista tai sairaanhoitajalta neuvoa ennen tämän lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
VEYVONDI ei todennäköisesti vaikuta ajokykyyn tai koneiden käyttökykyyn.
VEYVONDI sisältää natriumia
Tämä lääkevalmiste sisältää 5,2 mg natriumia (ruokasuolan toinen ainesosa) per 650 IU:n injektiopullo tai 10,4 mg natriumia per 1 300 IU:n injektiopullo.
Tämä vastaa 2,2 %:a suositellusta ravinnosta saatavasta aikuisten enimmäisvuorokausiannoksesta natriumia, kun henkilön oletettu paino on 70 kg ja annos on 80 IU/kg.
Tämä on otettava tämä huomioon, jos sinulla on ruokavalion natriumrajoitus.
3. Miten valmistetta käytetään
VEYVONDI‑hoitoa valvoo lääkäri, jolla on kokemusta von Willebrandin tautia sairastavien potilaiden hoidosta.
Lääkäri laskee tarvittavan VEYVONDI‑annoksen (kansainvälisinä yksikköinä, lyhenne IU). Annos riippuu seuraavista asioista:
- paino
- verenvuodon sijainti
- verenvuodon voimakkuus
- kliininen tilasi
- tarvittava leikkaus
- VWF‑aktiivisuus veressäsi leikkauksen jälkeen
- tautisi vaikeusaste
Lääkäri saattaa määrätä verikokeita varmistaakseen, että veresi von Willebrand ‑tekijän pitoisuus on riittävä. Tämä on erityisen tärkeää, jos sinulle tehdään suuri leikkaus.
Verenvuototapahtumien hoito:
Lääkärisi laskee sinulle sopivimman annoksen ja päättää, kuinka usein ja kuinka kauan VEYVONDI‑valmistetta tarvitsee ottaa.
Lievien verenvuotojen (esim. verenvuodon nenästä tai suusta, runsaiden kuukautisten) hoitoon kukin alkuannos on yleensä 40 – 50 IU/kg ja merkittävien vuotojen (vaikean tai sitkeän nenäverenvuodon, runsaiden kuukautisten, ruoansulatuskanavan verenvuodon, keskushermoston vaurion, verinivelen tai vamman aiheuttaman verenvuodon) hoitoon kukin alkuannos on 50 – 80 IU/kg. Annokset tämän jälkeen (kliinisen tarpeen mukaan) ovat lievien vuotojen hoidossa 40 – 50 IU/kg 8 – 24 tunnin välein niin kauan kuin kliinistä tarvetta arvioidaan olevan ja merkittävien vuotojen hoidossa 40 – 60 IU/kg n. 2 – 3 vuorokauden ajan.
Jos sinusta tuntuu, että VEYVONDI‑valmiste ei toimi riittävän hyvin, keskustele lääkärin kanssa. Lääkäri tekee tarvittavat laboratoriokokeet varmistaakseen, että veresi von Willebrand ‑tekijän taso on riittävä. Jos käytät VEYVONDI‑valmistetta kotona, lääkäri varmistaa, että sinulle opastetaan infuusion antaminen ja oikea annostus.
Verenvuodon ennaltaehkäisy elektiivisen leikkauksen yhteydessä:
Runsaan verenvuodon estämiseksi lääkäri määrittää FVIII:C‑pitoisuutesi 3 tunnin sisällä ennen leikkausta. Jos FVIII‑pitoisuutesi ei ole riittävä, saattaa lääkärisi määrätä sinulle 40–60 IU/kg VEYVONDI‑valmistetta 12–24 tuntia ennen elektiivisen leikkauksen aloittamista (leikkausta edeltävä annos) FVIII pitoisuuksiesi suurentamiseksi kohdearvoon (0,4 IU/ml pienten ja vähintään 0,8 IU/ml suurten leikkausten yhteydessä). Tunnin sisällä ennen leikkausta saat VEYVONDI‑annoksen, joka perustuu 3 tuntia ennen leikkausta tehtyyn määritykseen. Annos riippuu potilaan VWF‑ ja FVIII‑pitoisuuksista sekä mahdollisen vuodon tyypistä ja vaikeusasteesta.
Estohoito
Verenvuototapahtumien pitkäaikaisessa estohoidossa (profylaksi) tavanomainen aloitusannos on 40–60 IU/kg kahdesti viikossa. Annosta voidaan säätää siten, että enimmäisannos on 80 IU/kg yhdestä kolmeen kertaa viikossa potilaan tilan ja VEYVONDI-valmisteen toimivuuden mukaan. Lääkäri määrittää sinulle sopivan annoksen ja sen, kuinka usein ja kuinka pitkään saat VEYVONDI-valmistetta.
Miten VEYVONDI‑valmistetta käytetään
VEYVONDI‑valmisteen antaa tavallisesti lääkäri tai sairaanhoitaja infuusiona (tiputuksena) laskimoon. Tämän pakkausselosteen lopussa on yksityiskohtaiset ohjeet lääkkeen käyttökuntoon saattamisesta ja antamisesta.
Käyttö lapsille ja nuorille
VEYVONDI‑valmistetta ei ole hyväksytty alle 18 vuoden ikäisten lasten ja nuorten hoitoon.
Jos käytät enemmän VEYVONDI‑valmistetta kuin sinun pitäisi
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma. Jos otat suositeltua suuremman VEYVONDI‑infuusion, kerro siitä mahdollisimman pian lääkärille. Tahattomaan yliannostukseen voi liittyä verihyytymien (tromboosin) muodostumisriski.
Jos unohdat käyttää VEYVONDI‑valmistetta
- Älä infusoi kaksinkertaista annosta korvataksesi unohtamasi kerta‑annoksen.
- Ota seuraava infuusio aikataulun mukaisesti ja jatka hoitoa lääkärisi neuvomalla tavalla.
Jos lopetat VEYVONDI‑valmisteen käytön
Älä lopeta VEYVONDI‑valmisteen käyttöä keskustelematta ensin lääkärin kanssa.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
4. Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
VEYVONDI voi aiheuttaa vakavan allergisen reaktion.
Keskeytä infuusio ja ota välittömästi yhteyttä lääkäriin, jos saat jonkin seuraavista vaikeiden allergisten reaktioiden varhaisista oireista:
- ihottuma tai nokkosihottuma, yleistynyt kutina
- puristava tunne kurkussa tai rinnassa, rintakipu,
- hengitysvaikeudet, heikotus, sykkeen nopeutuminen
- huimaus, pahoinvointi tai pyörtyminen.
VEYVONDI‑valmisteen käytön yhteydessä ilmoitettuja haittavaikutuksia ovat:
Hyvin yleiset (saattaa esiintyä yli 1 potilaalla 10:stä)
Yleiset (saattaa esiintyä enintään 1 potilaalla 10:stä)
- pahoinvointi
- oksentelu
- infuusiokohdan kihelmöinti tai kuumotus
- epämiellyttävät rintatuntemukset
- heitehuimaus
- kiertohuimaus
- veritulpat
- kuumat aallot
- kutina
- korkea verenpaine
- lihasnykäisyt
- makuhäiriöt
- sykkeen nopeutuminen
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
5. Valmisteen säilyttäminen
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä kotelossa ja injektiopullon etiketissä mainitun viimeisen käyttöpäivämäärän käyt. viim. jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
- Säilytä alle 30 °C.
- Ei saa jäätyä.
- Säilytä alkuperäispakkauksessa. Herkkä valolle.
- Älä säilytä liuosta kylmässä käyttökuntoon saattamisen jälkeen.
- Käyttökuntoon saatettu valmiste on käytettävä 3 tunnin kuluessa mikrobikontaminaation riskin välttämiseksi, koska se ei sisällä säilytysaineita.
- Tämä valmiste on kertakäyttöinen. Hävitä käyttämättä jäänyt liuos asianmukaisella tavalla.
- Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
6. Pakkauksen sisältö ja muuta tietoa
Mitä VEYVONDI sisältää
Vaikuttava aine on vonikogi alfa (rekombinantti ihmisen von Willebrand ‑tekijä).
VEYVONDI 650 IU injektiokuiva‑aine ja liuotin, liuosta varten
Yksi injektiokuiva‑ainepullo sisältää nimellisesti 650 kansainvälistä yksikköä (IU) vonikogi alfaa.
Kun VEYVONDI on saatettu käyttökuntoon käyttämällä 5 ml pakkauksessa olevaa liuotinta, se sisältää noin 130 IU/ml vonikogi alfaa.
VEYVONDI 1 300 IU injektiokuiva‑aine ja liuotin, liuosta varten
Yksi injektiokuiva‑ainepullo sisältää nimellisesti 1 300 kansainvälistä yksikköä (IU) vonikogi alfaa.
Kun VEYVONDI on saatettu käyttökuntoon käyttämällä 10 ml pakkauksessa olevaa liuotinta, se sisältää noin 130 IU/ml vonikogi alfaa.
Muut aineet ovat:
- Natriumsitraatti, glysiini, trehaloosidihydraatti, mannitoli, polysorbaatti 80 ja injektionesteisiin käytettävä vesi.
- Ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä "VEYVONDI sisältää natriumia".
Lääkevalmisteen kuvaus ja pakkauskoko
VEYVONDI on valkoinen tai luonnonvalkoinen kuiva‑aine. Käyttökuntoon saattamisen jälkeen ruiskuun vedetty liuos on kirkasta ja väritöntä, eikä siinä näy saostumia tai muita vieraita hiukkasia.
Kukin VEYVONDI 650 IU ‑pakkaus sisältää:
- kuiva‑aine lasipullossa, jossa on kumitulppa
- 5 ml liuotinta lasipullossa, jossa on kumitulppa
- yhden laitteen valmisteen käyttökuntoon saattamista varten (Mix2Vial)
Kukin VEYVONDI 1300 IU ‑pakkaus sisältää:
- kuiva‑aine lasipullossa, jossa on kumitulppa
- 10 ml liuotinta lasipullossa, jossa on kumitulppa
- yhden laitteen valmisteen käyttökuntoon saattamista varten (Mix2Vial)
Myyntiluvan haltija
Baxalta Innovations GmbH
Industriestrasse 67
1221 Wien
Itävalta
Valmistaja
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Wien
Itävalta
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi
Takeda Oy
Puh/Tel: 0800 774 051
medinfoEMEA@takeda.com
Tämä pakkausseloste on tarkistettu viimeksi 11/2023
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu .
Lisäohjeet
Ohjeet käyttökuntoon saattamiseksi ja lääkkeen antamiseksi
Yleiset ohjeet
Tarkista viimeinen käyttöpäivämäärä ja varmista, että VEYVONDI‑kuiva‑aine ja injektionesteisiin käytettävä vesi (liuotin) ovat huoneenlämpöisiä ennen valmisteen käyttökuntoon saattamista. Älä käytä etiketeissä ja kotelossa mainitun viimeisen käyttöpäivämäärän jälkeen.
Käytä käyttökuntoon saattamisen aikana aseptista (puhdasta ja vähäbakteerista) tekniikkaa ja tasaista työskentelyalustaa. Pese kädet ja pue puhtaat tutkimuskäsineet (käsineiden käyttäminen on vapaaehtoista).
Käyttökuntoon saatettu valmiste tulee käyttää (kun kuiva‑aine on sekoitettu mukana toimitettuun veteen) mahdollisimman pian kolmen tunnin kuluessa. Käyttökuntoon saatettua valmistetta voi säilyttää huoneenlämmössä enintään 25 °C:ssa enintään kolmen tunnin ajan. Käyttökuntoon saatettua valmistetta ei saa säilyttää jääkaapissa. Se on hävitettävä kolmen tunnin kuluttua.
Varmista, että VEYVONDI‑kuiva‑aine ja steriili injektionesteisiin käytettävä vesi (liuotin) ovat huoneenlämpöisiä ennen valmisteen käyttökuntoon saattamista.
Käytä muoviruiskuja tämän valmisteen antamiseen, sillä valmisteen sisältämillä proteiineilla on taipumus tarttua lasisten ruiskujen pintaan.
Älä sekoita VEYVONDI‑valmistetta muiden lääkevalmisteiden kuin oktokogi alfan (ADVATE) kanssa.
Ohjeet käyttökuntoon saattamiseksi
| | Vaiheet | Kuvaesimerkki |
| 1 | Poista VEYVONDI‑kuiva‑aineen ja liuottimen sisältävistä injektiopulloista korkit ja paljasta kumitulppien keskustat. | 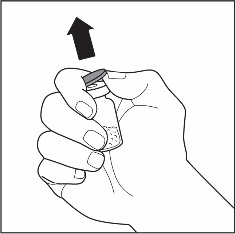 |
| 2 | Desinfioi jokainen tulppa erillisellä steriilillä desinfiointipyyhkeellä (tai muulla sopivalla, lääkärin tai hemofilian hoitoon erikoistuneen keskuksen suosittelemalla steriilillä liuoksella) pyyhkimällä tulppaa useiden sekuntien ajan. Anna kumitulppien kuivua. Aseta injektiopullot tasaiselle alustalle. | 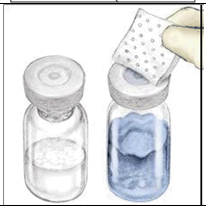 |
| 3 | Avaa Mix2Vial‑laitteen pakkaus vetämällä suojakansi kokonaan pois ilman, että kosketat pakkauksen sisäpuolta. Älä poista Mix2Vial‑laitetta pakkauksesta. | – |
| 4 | Käännä Mix2Vial‑laitteen pakkaus ylösalaisin ja aseta se liuottimen sisältävän injektiopullon päälle. Työnnä laitteen sininen muovipiikki kohtisuoraan liuotinpullon tulpan keskustan läpi. Tartu pakkaukseen sen reunasta ja vedä pakkaus irti Mix2Vial‑laitteesta. Älä koske läpinäkyvään muovipiikkiin. Liuottimen sisältävä injektiopullo on nyt kiinnitetty Mix2Vial‑laitteeseen ja valmis kiinnitettäväksi VEYVONDI‑injektiopulloon. | 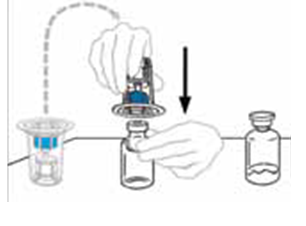 |
| 5 | Kiinnitä liuottimen sisältävä injektiopullo VEYVONDI‑injektiopulloon kääntämällä liuotinpullo ylösalaisin ja asettamalla se VEYVONDI‑konsentraatin sisältävän injektiopullon päälle. Työnnä läpinäkyvä muovipiikki kohtisuoraan VEYVONDI‑injektiopullon tulpan läpi. Tämä on tehtävä heti, jotta nesteeseen ei pääse taudinaiheuttajia. Tyhjiö vetää liuottimen VEYVONDI‑injektiopulloon. Tarkista, että liuotin on kokonaan siirtynyt. Älä käytä, jos tyhjiö ei ole vetänyt liuotinta VEYVONDI‑injektiopulloon. | 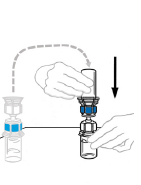 |
| 6 | Pyörittele toisiinsa liitettyjä injektiopulloja varovasti ja jatkuvasti, tai anna käyttökuntoon saatetun valmisteen tasaantua 5 minuutin ajan ja pyörittele sitä sitten varovasti, kunnes kuiva‑aine on liuennut täysin. Älä ravista. Ravistaminen huonontaa valmisteen laatua. Älä säilytä kylmässä käyttökuntoon saattamisen jälkeen. | 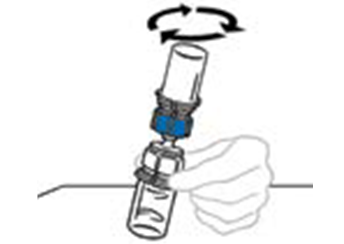 |
| 7 | Irrota Mix2Vial‑laitteen puoliskot toisistaan tarttumalla toisella kädellä VEYVONDI‑injektiopulloon kiinnitetyn Mix2Vial‑laitteen läpinäkyvään muoviosaan ja toisella kädellä liuotinpulloon kiinnitetyn Mix2Vial‑laitteen siniseen muoviosaan. Irrota injektiopullot varovasti toisistaan kiertämällä sinistä muoviosaa vastapäivään. Älä koske liuotetun valmisteen sisältävään VEYVONDI‑injektiopulloon kiinnitetyn muovisen liitoskappaleen päähän. Aseta VEYVONDI‑injektiopullo tasaiselle työtasolle. Hävitä tyhjä liuotinpullo. | 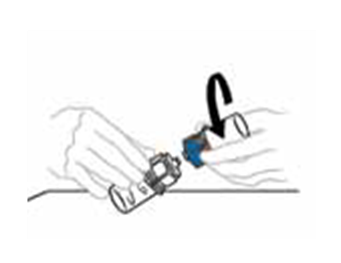 |
| 8 | Vedä tyhjään, steriiliin, kertakäyttöiseen muoviruiskuun ilmaa vetämällä mäntää taaksepäin. Ruiskuun vedettävän ilman määrän tulisi olla yhtä suuri kuin injektiopullosta vedettävän, käyttökuntoon saatetun VEYVONDI‑valmisteen määrä. | 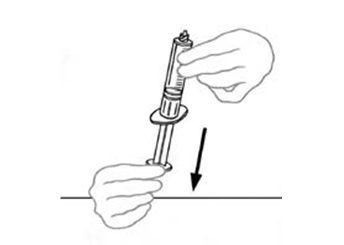 |
| 9 | Laita VEYVONDI‑injektiopullo (joka sisältää liuotetun valmisteen) tasaiselle työtasolle, kiinnitä ruisku läpinäkyvään muoviseen liitoskappaleeseen ja kierrä ruiskua myötäpäivään | 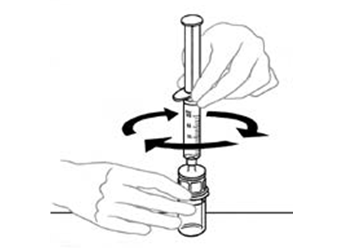 |
| 10 | Pidä injektiopulloa toisessa kädessä ja paina toisella kädellä kaikki ilma ruiskusta injektiopulloon. | 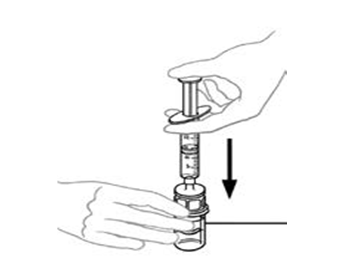 |
| 11 | Käännä toisiinsa liitetyt ruisku ja VEYVONDI‑injektiopullo ylösalaisin niin, että injektiopullo on päällimmäisenä. Varmista, että ruiskun mäntä on painettu pohjaan. Vedä VEYVONDI‑valmiste ruiskuun vetämällä mäntää hitaasti taaksepäin. | 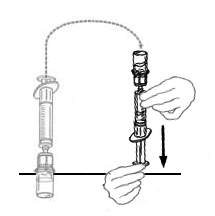 |
| 12 | Älä siirtele liuosta ruiskusta injektiopulloon ja takaisin. Se voi heikentää lääkkeen laatua. Kun olet valmis antamaan infuusion, irrota ruisku kiertämällä sitä vastapäivään. Tarkista ruisku silmämääräisesti hiukkasten varalta. Ruiskussa olevan liuoksen tulee olla kirkasta. Jos liuoksessa on saostumia tai hiukkasia, sitä ei saa käyttää. Ota yhteys lääkäriin. | 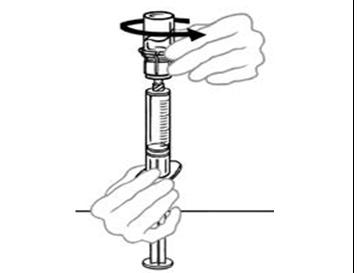 |
| 13 | - Jos annokseen tarvitaan enemmän kuin yksi VEYVONDI‑injektiopullo:
- Jätä ruisku kiinni injektiopulloon, kunnes seuraava injektiopullo on valmis käytettäväksi.
- Valmistele seuraava VEYVONDI‑injektiopullo käyttökuntoon uutta Mix2Vial‑laitetta käyttäen ja yllä kuvattuja vaiheita (2–8) noudattaen
| |
| 14 | Yhteen ruiskuun voi vetää kahden injektiopullon sisällön. HUOMAUTUS: Kun painat ilmaa toiseen VEYVONDI‑injektiopulloon, jonka sisältö on tarkoitus vetää samaan ruiskuun, varmista, että ruiskuun liitetty injektiopullo on käännetty ylösalaisin (injektiopullo ruiskun yläpuolella). | |
Ohjeet lääkkeen antamiseksi
Tarkista ruiskussa oleva, käyttökuntoon saatettu liuos hiukkasten ja värimuutosten varalta ennen antoa (liuoksen tulee olla kirkasta ja väritöntä, eikä siinä saa olla hiukkasia). Injektiopulloon jää usein hiukan saostumia tai hiukkasia valmisteen käyttökuntoon saattamisen jälkeen. Mix2Vial‑laitteen suodatin poistaa nämä hiukkaset täysin. Suodatus ei vaikuta annoksen laskentaan. Ruiskussa olevaa liuosta ei saa käyttää, jos se on sameaa tai sisältää suodatuksen jälkeen saostumia tai hiukkasia.
- Kiinnitä infuusioneula VEYVONDI‑liuoksen sisältävään ruiskuun. Potilasmukavuuden vuoksi on suositeltavaa käyttää siipineulalla varustettua infuusiolaitteistoa. Aseta neulan kärki ylöspäin ja poista kaikki ilmakuplat naputtamalla ruiskua kevyesti sormellasi. Poista ilma ruiskusta ja neulasta painamalla mäntää hitaasti ja varovasti.
- Tee kiristysside ja valmistele infuusiokohta puhdistamalla iho perusteellisesti steriilillä desinfiointipyyhkeellä (tai muulla sopivalla, lääkärin tai hemofilian hoitoon erikoistuneen keskuksen suosittelemalla steriilillä liuoksella).
- Vie neula laskimoon ja avaa kiristysside. Anna VEYVONDI hitaana infuusiona. Infuusionopeus saa olla enintään 4 ml minuutissa. Irrota tyhjä ruisku. Jos annokseen tarvitaan useita ruiskuja, kiinnitä ja annostele seuraavat VEYVONDI‑valmistetta sisältävät ruiskut yksi kerrallaan.
Huomautus:
Älä poista siipineulaa äläkä koske ruiskun liittimenä toimivaan Luer‑porttiin, ennen kuin kaikkien ruiskujen sisältö on annettu.
Jos lääkäri on määrännyt rekombinanttia tekijää VIII, anna rekombinantti tekijä VIII 10 minuutin kuluessa siitä, kun koko VEYVONDI‑infuusio on annettu. - Poista neula laskimosta ja paina infuusiokohtaa steriilillä harsotaitoksella useiden minuuttien ajan.
Jos VEYVONDI‑valmistetta on tarpeen antaa suurina tilavuuksina, kahden VEYVONDI‑injektiopullon sisältö voidaan yhdistää. Käyttökuntoon saatettujen VEYVONDI‑injektiopullojen sisällön voi vetää samaan ruiskuun. Tällöin käyttökuntoon saatettua liuosta ei saa kuitenkaan laimentaa edelleen.
Älä laita neulansuojusta takaisin paikoilleen. Laita neula, ruisku ja tyhjä(t) VEYVONDI‑valmisteen ja liuottimen injektiopullo(t) terävälle jätteelle tarkoitettuun kovaseinäiseen astiaan odottamaan asianmukaista hävittämistä. Älä hävitä näitä tarvikkeita talousjätteen mukana.
------------------------------------------------------------------------------------------------------------------------
Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille:
Verenvuototapahtumien hoito (tarvittaessa annettava hoito)
Annos ja antoväli määritetään yksilöllisesti lääkärin harkinnan perusteella, ja seuraavat asiat on otettava huomioon: verenvuototapahtuman vaikeusaste, verenvuodon sijainti, potilaan sairaushistoria ja asianmukaisten kliinisten arvojen ja laboratorioarvojen seuranta (sekä VWF:RCo‑ että FVIII:C‑pitoisuudet).
Hoidon aloitus
VEYVONDI‑valmistetta pitää antaa yhdessä rekombinantin tekijä VIII:n kanssa verenvuodon hallitsemiseksi, jos FVIII:C‑pitoisuudet ovat alle 40 % tai jos ne eivät ole tiedossa. Potilaan rFVIII‑annos lasketaan plasman FVIII:C‑perustason ja halutun FVIII:C‑huippupitoisuuden välisen eron perusteella, jotta saavutetaan keskimääräiseen saantoon 0,02 (IU/ml)/(IU/kg) perustuva asianmukainen plasman FVIII:C‑pitoisuus. rFVIII‑valmistetta pitää antaa 10 minuutin sisällä siitä, kun VEYVONDI‑annos on kokonaisuudessaan annettu.
Annoksen laskeminen
VEYVONDI‑annos [IU] = annos [IU/kg] x kehon paino [kg]
Seuraavat infuusiot
Seuraavat annokset VEYVONDI‑valmistetta 40–60 IU/kg annetaan infuusiona 8–24 tunnin välein taulukossa 1 annettujen annostusohjeiden mukaisesti niin kauan kuin se on kliinisesti tarpeellista. Merkittävien verenvuotojen kohdalla VWF:RCo‑pitoisuus on pidettävä vähintään 50 %:ssa niin kauan kuin se katsotaan tarpeelliseksi.
| Taulukko 1. Annossuositukset lievien ja merkittävien verenvuotojen hoitoon | |
| Verenvuoto | Aloitusannos a (IU VWF:RCo / kg) | Seuraava annos |
Lievä (esim. verenvuoto nenästä tai suusta, runsaat kuukautiset) | 40–50 IU/kg | 40–50 IU/kg 8–24 tunnin välein (tai kliinisen tarpeen mukaan) |
Merkittävä b (esim. vaikea tai sitkeä nenäverenvuoto, runsaat kuukautiset, ruoansulatuskanavan verenvuoto, keskushermoston vaurio, verinivel tai vamman aiheuttama verenvuoto) | 50–80 IU/kg | 40–60 IU/kg 8–24 tunnin välein noin 2–3 päivän ajan (tai kliinisen tarpeen mukaan) |
aJos potilaalle annetaan rFVIII‑valmistetta, tarkista ohjeet rFVIII‑valmisteen käyttökuntoon saattamisesta ja antamisesta kyseisen valmisteen pakkausselosteesta. bVerenvuoto voidaan katsoa merkittäväksi, jos potilas tarvitsee välttämättä tai mahdollisesti punasolusiirron tai jos verenvuoto sijaitsee jossakin kriittisen tärkeässä paikassa (esim. kallonsisäinen tai ruoansulatuskanavan verenvuoto). |
Verenvuodon ennaltaehkäisy ja hoito elektiivisen leikkauksen yhteydessä
Arvioi FVIII:C‑pitoisuudet ennen minkään kirurgisen toimenpiteen tekemistä. Pienin suositeltu tavoitetaso on 0,4 IU/ml pienten leikkausten ja suun alueen leikkausten yhteydessä ja 0,8 IU/ml suurten leikkausten yhteydessä.
Sen varmistamiseksi, että elimistön FVIII‑pitoisuus ennen leikkausta on vähintään kohdearvossa (vähintään 0,4 IU/ml pienten ja suun alueen leikkausten yhteydessä sekä 0,8 IU/ml suurten leikkausten yhteydessä), potilaalle voidaan antaa 40–60 IU/kg VEYVONDI‑valmistetta 12–24 tuntia ennen elektiivistä leikkausta (leikkausta edeltävä annos). Enintään tuntia ennen leikkausta potilaalle tulee antaa VEYVONDI‑annos, joka perustuu 3 tuntia ennen leikkausta suoritettuun määritykseen. Annos riippuu potilaan VWF‑ ja FVIII‑pitoisuuksista sekä verenvuodon tyypistä ja vaikeusasteesta.
Jos FVIII‑pitoisuudet eivät ole suositusarvoissa, potilaalle pitää antaa annos pelkkää VEYVONDI‑valmistetta enintään 1 tunti ennen toimenpidettä. Jos FVIII:C‑pitoisuudet eivät ole suositelluissa kohdearvoissa, potilaalle pitää antaa vonikogi alfan lisäksi rFVIII‑valmistetta VWF:RCo‑ ja FVIII:C‑pitoisuuksien suurentamiseksi. Tarkista taulukosta 2 suositellut FVIII:C‑tavoitearvot.
| Taulukko 2. Suositetut VWF:RCo:n ja FVIII:C:n huipputavoitetasot plasmassa ennen leikkausta runsaan verenvuodon ehkäisemiseksi leikkauksen aikana ja sen jälkeen |
| Leikkauksen tyyppi | Haluttu plasman VWF:RCo‑ huippupitoisuus | Haluttu plasman FVIII:C‑ huippupitoisuus a | rVWF‑annoksen (annetaan enintään 1 tunti ennen leikkausta) laskeminen (tarvittava IU VWF:RCo) |
| Lievä | 0,5–0,6 IU/ml | 0,4–0,5 IU/ml | ∆b VWF:RCo x paino (kg) /IR c |
| Merkittävä | 1 IU/ml | 0,80–1 IU/ml | ∆b VWF:RCo x paino (kg) /IR c |
| a rFVIII‑lisäannos voi olla tarpeen plasman suositellun FVIII:C‑huippupitoisuuden saavuttamiseksi. Annostusohjeet pitää antaa IR‑arvon perusteella. |
| b ∆ = Plasman VWF:RCo‑huippupitoisuus – plasman VWF:RCo‑perustaso |
| cIR = potilaasta mitattu inkrementaalinen saanto (incremental recovery). Jos IR‑arvoa ei ole käytettävissä, sen oletetaan olevan 0,02 IU/ml per IU/kg. |
Leikkauksen aikana ja leikkauksen jälkeen
Kun kirurginen toimenpide on aloitettu, plasman VWF:RCo‑ ja FVIII:C‑pitoisuuksia on seurattava, ja leikkauksen aikana ja sen jälkeen annettava korvaushoito on räätälöitävä yksilöllisesti farmakokineettisten tulosten, verenvuodon voimakkuuden ja keston sekä laitoksen omien hoitokäytäntöjen perusteella. Leikkauksen jälkeen annettavassa korvaushoidossa VEYVONDI‑valmisteen annosväli on 12 ‑ 48 tuntia. Katso myöhempiä ylläpitoannoksia koskevat hoitosuositukset taulukosta 3.
| Taulukko 3. Suositetut VWF:RCo:n ja FVIII:C:n vähimmäistavoitetasot ennen leikkausta ja hoidon vähimmäiskestot annettaessa myöhempiä ylläpitoannoksia runsaan verenvuodon ennaltaehkäisyyn leikkauksen jälkeen |
| Leikkauksen tyyppi | VWF:RCo Haluttu plasman vähimmäispitoisuus | FVIII:C Haluttu plasman vähimmäispitoisuus | Hoidon vähimmäiskesto | Antoväli |
| Enintään 72 tuntia leikkauksen jälkeen | Yli 72 tuntia leikkauksen jälkeen | Enintään 72 tuntia leikkauksen jälkeen | Yli 72 tuntia leikkauksen jälkeen |
| Lievä | ≥ 0,30 IU/ml | ‑ | > 0,40 IU/ml | ‑ | 48 tuntia | 12–24 tunnin välein / joka toinen päivä |
| Merkittävä | > 0,50 IU/ml | > 0,30 IU/ml | > 0,50 IU/ml | > 0,40 IU/ml | 72 tuntia | 12–24 tunnin välein / joka toinen päivä |
Estohoito
Verenvuotojen pitkäaikaisen estohoidon aloitukseen VWD-potilailla on harkittava 40–60 IU/kg:n VEYVONDI-annosta kahdesti viikossa. Potilaan tila ja kliininen vaste, välivuodot mukaan luettuina, voivat edellyttää suurempia annoksia (enintään 80 IU/kg) ja/tai tiheämpää antoväliä (enintään kolme kertaa viikossa).
Lääkevalmisteen nimi ja eränumero
Aina kun potilaalle annetaan VEYVONDI‑valmistetta, on hyvin suositeltavaa kirjata muistiin valmisteen nimi ja eränumero, jotta valmiste‑erää koskevat tiedot jäävät potilastietoihin.